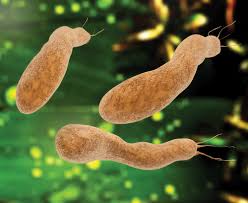
هيليكوباكتر بايلوري هي بكتيريا تصيب الغشاء المخاطي المعوي. إن بنيتها الخارجية هيكلية (وبالتالي اسمها “هيليكوباكتر”). وهي مجهزة بالفلاميلا.
80% من القرحة المصابة بفيروس الهليكوباكتر (Helicobacter pylori1) ، على الرغم من أن المرض لا يزال دون أعراض في العديد من البشر المصابين. إنها تروج لأمراض متعددة إذا بقيت في المعدة لسنوات عديدة.
إن الهيليكوباكتر بيلوري عبارة عن بكتيريا شائعة للغاية (توجد في 50% من البشر) 2. وهي تعيش حصرا في معدة الإنسان وهي البكتريا الوحيدة المعروفة التي تستطيع البقاء على قيد الحياة في مثل هذه البيئة الحمضية. مغلفتها الهليكوبتر يمكن أن تساعدها على العبث في مخاط جدار المعدة من أجل الاستعمار والاستمرار.
جدول المحتويات
اكتشاف عرضي لهيليكوباكتر بايلوري
وقد أعيد اكتشاف هذه البكتيريا عن طريق الخطأ في عام 1982 من قِبَل باحثين أستراليين ، هما جون روبن وارن (أخصائي الأمراض) وباري ج. مارشال (أخصائي في علم المعدة) ، اللذين عزلا وزرعا الكائنات الحية من المعدة البشرية. وقد جادل وارن ومارشال في منشورهما الأصلي بأن معظم القرحة المعدية والمعدة سببها عدوى هذه البكتريا ، وليس بسبب الإجهاد أو الطعام الحار ، كما كان يعتقد سابقا. وقد حصل الاكتشاف على جائزة نوبل في الفيزيولوجيا أو الطب عام 2005.
كان المجتمع الطبي بطيئاً في التعرف على دور هذه البكتيريا في القرحة المعوية ، معتقداً أنه لا يمكن لأي بكتيريا البقاء على قيد الحياة لفترة طويلة في البيئة الحمضية للمعدة. وبعد إجراء المزيد من الدراسات ، بما في ذلك الدراسة التي قام خلالها مارشال بتناول أنبوب اختبار لفيروس H. Pylori ، والتهاب المعدة المصاب به (لم يكن لديه الصبر على انتظار تطوير قرحة) وعلاجه بالمضادات الحيوية (وبالتالي إرضاء ثلاثة من الوظائف الأربع لروبرت كوخ) ، بدأ المجتمع الطبي في تغيير رأيه. ضروري]. في عام 1994 ، نشرت المعاهد الوطنية للصحة ورقة تحتج بأن معظم القرحة المعوية المتكررة سببها H. Pylori ، وأوصت بأن المضادات الحيوية
هيكل البكتريا
H. Pylori هي بكتيريا سلبية الغرام على شكل هيلوجيني ، يبلغ طولها حوالي ثلاثة ميكرومتر وقطرها حوالي 0.5 ميكرومتر. وهي ترتدي أربعة إلى ستة بلاميل (4). ويسمى microaerophilic ، أي أنه يتطلب إمدادات من الأكسجين ، ولكن بنسب أقل من تلك الموجودة في الغلاف الجوي. وأخيرا ، يمكن أن تنتج طاقتها عن طريق توليد الميثانيوم من الهيدروجين. وبفضل هيليكوبتر هيليكوبتر وفلاميلا ، تنحدر البكتيريا من خلال المخاط وأحياناً الأغشية المخاطية للمعدة ، وترسخ نفسها إلى الخلايا الظهارية بفضل الالتصاقات (البروتينات المثبتة). ثم يفرز إنزيم يسمى اليورياس ، الذي يحول اليوريا إلى الأمونيا وثاني أكسيد الكربون. وسوف تعمل هذه الأمونيا على تحييد حموضة المعدة جزئياً (التي تستخدم للتنبؤ بالغذاء ، في حين تقتل أغلب البكتيريا). ولكن من المؤسف أن الأمونيا سامة للخلايا الظهارية ، وتذهب إلى جانب منتجات أخرى تفرزها H. Pylori (البروتينات ، والكتالونات ، والفوسفوليباز ، وما إلى ذلك) ، فتبدأ عملية تكوين القرحة.
إقرأ أيضا:حروق المعدةعلم الوراثة
قد تم ترتيب الجينوم H. Pylori منذ عام 1997. ولا يزال وضع وعدد الجينات التنظيمية ، التي تنظم توليف المنتجات من الجينات الأخرى ، غير مفهومين بشكل جيد. كما تلعب ستون جزيئة أو نحو ذلك من جزيئات الرنا الصغيرة المسماة ” الصغيرة” دوراً في تثبيط المنظم ، وذلك من خلال إلزام تسلسلات الجينات ، الأمر الذي يؤدي إلى عرقلة ترجمة البروتينات التي ترمزها هذه الجينات. وقد تم تحديدها في 2009/20106 حسب تسلسل .
هذا فاجأ الباحثين لأنه كان يعتقد سابقا أن كان خاليا من. ومع ذلك ، فإنلديها العديد أو أكثر مثل البكتيريا المعوية مثل Ascherichia coli والسالمونيلا. ومع ذلك ، فإن البروتين المعروف أنه أساسي لتنظيم غائب في H pylori ، مما يشير إلى أن لديه اليوم أنظمة إشارة داخلية غير معروفة.
علم الأوبئة في هيليكوباكتر بايلوري
حوالي ثلثي سكان العالم مصابون بهذه البكتيريا. ويختلف معدل الإصابة من بلد إلى آخر: نحو 25% في البلدان الغربية التي تعاني من تفاوت كبير. أما في الولايات المتحدة ، فإن المتضررين هم في الأساس من كبار السن (أكثر من 50% المصابين بعد سن 60 عاماً ، مقارنة بنحو 20% من أولئك الذين تقل أعمارهم عن 40 عاماً) ، فضلاً عن أفقر الناس. والمعدل أعلى في بلدان العالم الثالث. وفي هذه الحالة الأخيرة ، من الشائع مواجهة الأطفال المصابين ، ربما بسبب سوء الظروف الصحية.
طفرة في الجين TLR1 ترميز مستقبلات شبيه تارت يمكن أن تكون عاملا مساهما في العدوى .
ومعدل الإصابة هو أساسا من وظائف الظروف الصحية ، فضلا عن درجة استخدام المضادات الحيوية. ومع ذلك ، ظهرت مقاومة بعض المضادات الحيوية في بعض سلالات H. Pylori. على سبيل المثال ، يمكن العثور على بعض السلالات المقاومة للميترونيدازول في بريطانيا العظمى.
الإرسال من هيليكوباكتر بايلوري
وقد تم عزل هذه البكتريا هيليكوباكتر بايلوري من صفيحات البراز واللعاب والأسنان ، مما يشير إلى أن انتقال العدوى ممكن عن طريق ابتلاع غذاء أو ماء فموي فاخر أو معوي.
وإذا لم تعالج بالمضادات الحيوية ، فسيبدو أن عدوى H. Pylori قد تستمر مدى الحياة. وبالتالي فإن الجهاز المناعي البشري لن يكون قادرا على استئصال هذه البكتيريا ، بسبب الآليات التي لديه لإحباط الجهاز المناعي. ومن الممكن أن تؤدي العدوى بعد ذلك إلى العديد من الأمراض الخطيرة: ورم الغدة النخامية ، أو ورم الغدة النخامية ، أو ورم الغدة النخامية ، أو سرطان المعدة.
التشخيص
يمكن اكتشاف وجود H. Pylori بطرق مختلفة
باستخلاص اليوريا التي تحمل علامة الكربون 13 (إذا كان المريض مصابا ، يتم استقلاب هذا اليوريا بواسطة H. pylori ، مما ينتج CO2 ملحوظة ، يتم طردها بعد ذلك من الجسم عن طريق الرئتين ، وبالتالي يمكن اكتشافها عن طريق تحليل الغاز المستخرج) 9. وهذا الاختبار ، غير الغازي ، يتمتع بموثوقية جيدة للغاية ؛ ويسددها الضمان الاجتماعي بنسبة 65 في المائة في عام France10.
الكشف في المقعد عن طريق علم المناعة أو علم المناعة. وقد ثبت أن هذه الطريقة موثوقة للتشخيص الأولي وكذلك للتحقق من نجاح العلاج
كما أن عمليات التنظير التي أجريت أثناء تنظير المعدة تجعل من الممكن ملاحظة آفات مؤذية محتملة على العرين والفرادوس. ويمكن إجراء اختبار اليورياس مباشرة: حيث تقوم الأخيرة بتحويل اليوريا إلى أمونيا ، ويتم اكتشافها بواسطة قياس الألوان بالأس الهيدروجيني ، مما يسمح بفحص شبه فوري للهليكوبتر.
وتحديد أجسام مضادة محددة ، والاختبار المصلي موثوق به للكشف عن عدوى ما ، دون أن يتمكن من مواعدتها. ولا يستخدم للتحقق من نجاح العلاج المضاد للهيليكوباكتر لأن الأجسام المضادة تبقى بعد عدة أشهر من الاستئصال المحتمل. وتتوفر مجموعات الفحص السيرولوجية للفحص شبه الفوري ، ولكنها أقل موثوقية من السيرولوجيا التقليدية. لم يعد يوصى بعلم السيرولوجيا بعد الآن.
الأمراض المتصلة بهذه العدوى
ويسبب مرض الهيليكوباكتر (Helicobacter pylori) عدة أمراض خطيرة إلى حد ما حسب الأفراد. هذه الجراثيم تسبب:
وعسر التنفس غير المعدي ؛
والقرحة المعوية و/أو القرحة الثنائية ؛
والتهاب المعدة المزمن غالبا ما يكون موضعيا على العرين من هيليكوباكتر بايلوري ولكنه يمتد أحيانا على العانة. وفي هذه الحالة ، نتحدث عن البانجستريت ؛
وسوء استعمال فيتامين B12 ؛
والتهاب المعدة اللاهوائي الذي يؤدي إلى نقص كلوريديريا أو حتى الأوكلوريديريا ؛
والمعدل المعوي الذي يعكس مرحلة مسبقة ؛ السرطانات (سرطان المعدة – ورم الغدد التناسلية الأدينوكاركينوما): يعتقد أن الهيليكوباكتر هو أحد عوامل الخطر الرئيسية لسرطان المعدة. والقضاء على هذه الجرثومة يقلل بشكل كبير من تواتر هذا النوع من السرطانات (19).
قد يساهم H. pylori في بداية مرض باركنسون واستئصال الهيليكوباكتر بيلوري من شأنه أن يحسن نتائج علاج الليفودوبا
الفوائد
وجود هيليكوباكتر سيكون حماية من سرطان المريء . ومع ذلك ، هذا النوع من السرطان هو أكثر نزعة من ذلك بكثير من المعدة التي تساعد البكتيريا هيليكوباكتر بايلوري على التسبب. وقد أظهرت الاكتشافات الأخيرة أن البكتيريا ليست بالضرورة مسببة للأمراض ، وأنها يمكن أن يكون لها آثار وقائية ضد السمنة والنوع 2 23 السكري. وسينتج المرض في الواقع عن تفاعل التراث الجيني للبكتريا مع جهاز المناعة.
معالجة العدوى
وهناك عدة توصيات دولية بشأن إدارة الهيليكوباكتر. وتعرف التوصيات الأوروبية باسم مؤتمر ماستريخت الخامس لتوافق الآراء ونشرت في عام 201524. ونشرت توصيات أمريكية في عام 200725.
ويحد العلاج بدرجة كبيرة من خطر تكرار القرحة الهضمية ويحسن الوشاح (26).
في حالات خلل التنسج غير المعقد ، فإنه يحسن الأعراض.
وقد يقلل أيضا من خطر الإصابة بسرطان المعدة في حالة الإصابة بجلطة مسبقة
يتم فحص فعالية العلاج في معظم الأحيان بواسطة سلبية اختبار الجهاز التنفسي اليورياس.
المعالجة بالمضادات الحيوية
ويستند العلاج الذي أوصت به الهيئة العليا للصحة إلى خوارزمية تدمج نوعين رئيسيين من العلاج: العلاج المضاد للسموم (bismuthea quaditherapy) وما يصاحبه من مرض هارت (HART).
ويشكل ما يسمى العلاج الثلاثي “المصاحب” “العلاج الموجه” ، أي الاسترشاد بنتيجة تحليل المقاومة للمضادات الحيوية لهيليكوباكتر بايلوري. وتتألف من:
أموكسيسيلين 1 غ صباح ومساء
الجرعة الكاملة من PPI (الجرعة العلاجية) صباحا ومساء ، اعتمادا على الدواء المعني
كلاريثروميسين 500 مغ صباح ومساء إذا كانت البكتيريا حساسة للجزيء ، وإلا فإن ليفوفلوكساسين 500 مغ صباح ومساء.
ويشكل ما يسمى “pismutée” quadritherapy “المعاملة الاحتمالية”.
أي لا تسترشد بمقاومة البكتيريا هيليكوباكتر بايلوري .ويستخدم هذا العلاج أيضا إذا كانت البكتيريا مقاومة للكلاريثروميسين والليفوفلوكساسين. وتتألف من 10 أيام من:
3 كبسولات البيليرا 4 مرات يوميا تحتوي على مادة نشطة: ميترونيدازول 125 ميغرام ، تيتراسيكلين كلوراهيدرات 125 ميغرام ، بوتاسيوم بيسموث فرعي 140mg30
الجرعة الكاملة من PPI (الجرعة العلاجية) صباحا ومساء ، اعتمادا على الدواء المعني
وهناك أيضا بديل عن pismuthea quadritherapy يسمى “مترافق” quadritherapy ، الذي يستند إلى تركيبة 14 يوما من Amoxicillin ، Clarithromycin ، Metronidazole و PPI.
ويمكن أن يعقب هذا العلاج الذي يستغرق 10 أيام ، حسب الاقتضاء ، علاج فردي الجرعة
أملاح بيسموث
كما يمكن استخدام أملاح البسموث (المعدن الثقيل) بالاقتران مع العلاج الثلاثي. ومع ذلك ، تم حظر bismuth في فرنسا منذ السبعينات نتيجة لحالات التسمم ومشاكل الكلى ، فضلا عن الأوبئة الدماغية المدرجة ، ولا سيما في حالات الجرعة الزائدة. ولا يزال الوصف الموصوف بنجاح في العديد من البلدان الأخرى. حتى أنه عاد إلى فرنسا بالاشتراك مع tetracycline وmertonidazole تحت اسم PYLERA. وحتى الآن ، لم يتم الإبلاغ عن حالات اعتلال الدماغ باستخدام PYLERA32. ونظراً لانخفاض فعالية العلاج الثلاثي التقليدي في المقام الأول بسبب مقاومة كلاريثروميسين (التي تقدر بنسبة 20%) .
رصد عمليات الإبادة
نظرا لخطر فشل العلاج على هيليكوباكتر بايلوري، من الضروري التحقق بشكل منتظم من أن الهيليكوباكتر قد تم القضاء عليه من المعدة.
وسيجري هذا الفحص في معظم الأحيان عن طريق اختبار الجهاز التنفسي ، وهو الفحص الأساسي.
ولكن هذا الاختبار التنفسي لا يصلح إلا إذا أجري بعد 4 أسابيع على الأقل من توقف المضادات الحيوية وبعد 2 أسابيع على الأقل من توقف العلاج بمضخة البروتون.